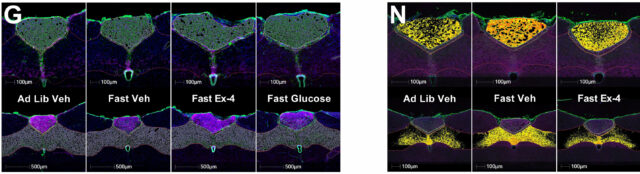
Imagens representativas do mRNA do DBI (G) e da proteína (N). Os dados são médios ± SEM. Cada experimento foi entre indivíduos; ((A) a (g)) n = 5 a 9 por tratamento e (h) a (m)) n = 3 ou 4 por tratamento. Símbolos * ou # denotando importância entre grupos de tratamento em intensidade fluorescente leve ou moderada. O sinal fluorescente foi estratificado por intensidade leve, moderada ou forte no software de análise halo e usada universalmente em todas as imagens. Os dados foram analisados com ANOVA de duas via com o post hoc de Tukey ((a) a (M)). Crédito: Caroline Geisler
Os pesquisadores da Universidade da Pensilvânia e da Universidade de Syracuse descobriram que um peptídeo derivado do cérebro traseiro, Octa Canopeptide (ODN), pode suprimir o apetite e melhorar a regulação da glicose sem causar náusea ou vômito. Os resultados sugerem um eixo de sinal da glia-neurônios no complexo vagal dorsal que pode ser usado para o tratamento da obesidade e diabetes tipo 2.
As células gliais no tronco cerebral produzem ODN, um peptídeo de sinal cujo papel fisiológico na energia -homeostase permaneceu incerto. Os pesquisadores agora descobrem que ativam diretamente esse sistema peptídico no cérebro traseiro induz a perda de peso, melhora o descarte de glicose e reduz a resistência à insulina em animais gordos.
Ao contrário das terapias existentes focadas nos receptores GLP-1, o ODN alcança esses efeitos sem desencadear comportamentos ou emeses relacionados a náusea em modelos de vômitos competentes.
A obesidade e o diabetes tipo 2 são caracterizados por sistemas biológicos que mantêm aumento da massa gorda e glicose no sangue como se fossem normais. Na obesidade, a perda de peso pode desencadear respostas contra -regulação que aumentem a fome e reduzem o consumo de energia.
No diabetes tipo 2, a saída de glucose no fígado também aumentou mesmo quando a glicose no sangue já está alta. Esses pontos de ajuste desadaptativos resistem à correção e complicam o tratamento longo a longo prazo.
O núcleo de energia central é a chave para essa rigidez. Regiões cerebrais como o hipotálamo e o complexo vagal dorsal (DVC) detectam alterações nos nutrientes circulantes e derivados de intestinais.
Em condições saudáveis, esse sistema suporta flexibilidade na ingestão de energia e no descarte de glicose. No caso de obesidade e diabetes, essa detenção é perturbada. Como resultado, os circuitos neurais que normalmente regulam as homeostas são tendenciosos contra a manutenção do excedente.
Embora grande parte da pesquisa tenha se concentrado em neurônios, células glia, astrócitos e tanicyter emergiram como atores -chave no detenção nutricional e no equilíbrio energético.
Os astrócitos respondem ao departamento de glicose e contribuem para a alimentação da supressão e regulação glicêmica, especialmente no cérebro traseiro. Os tanicitos parecem glicose, aminoácidos e lipídios e transmite o acesso ao hormônio ao cérebro, incluindo agonistas do receptor de insulina e GLP-1.
Ambos os tipos de células produzem opeptídeo de sinal -derivado de inibidores de diazepambinding (DBI), em áreas próximas aos ventrículos do cérebro. Trabalhos anteriores mostraram que a expressão e liberação de ODN no hipotálamo são estimuladas por glicose e renascimento. Sua função no DVC permaneceu em grande parte inexplorada.
No estudo, “Gliotransmissão europeptida do cérebro posterior como um alvo terapêutico para controle de energia sem náusea ou EMEs”, publicado em medicina translacional científica, os pesquisadores projetaram uma série de experimentos para avaliar se a sinalização de ODN na retaguarda regendo a alimentação, glicemia, glicemia e hormer.
As experiências foram realizadas sobre ratos, ratos e parafusos de almíscar usando ODN e um analógico modificado, tridecano europeptídeo (TDN). Os investigadores investigaram ainda se os agonistas do receptor GLP-1 alteram a expressão do DBI e se a sinalização de ODN contribui para a anorexia induzida por GLP-1.
Os pesquisadores administraram ODN ou TDN por injeção intracerebroventricular para os ventrículos de quarto ou lateral para avaliar os efeitos na ingestão de alimentos, tolerância à glicose, sensibilidade à insulina e liberação de hormônios.
O tecido cerebral foi coletado para imunofluorescência e hibridação in situ para quantificar a expressão do DBI nos subnúcleos do complexo vagal dorsal. Métodos de dados transcriptômicos de núcleos únicos foram usados para localizar transcrições do DBI em populações gliais.
O ODN suprimiu a ingestão de alimentos em ratos mantidos em chow ou dietas gordurosas, com um efeito anorético mais longo e redução de peso corporal em animais gordurosos induzidos pela dieta. A análise do padrão -alvo mostrou que o ODN reduziu o tamanho da refeição e a duração dos ratos de gordura, enquanto os efeitos dos ratos magros foram menos pronunciados.
A administração do ODN melhorou a tolerância à glicose e a sensibilidade à insulina em ratos magros e gordurosos sem aumentar a secreção de insulina. Antagonismo do receptor ODN prejudicou a distância da glicose e aumentou a glicemia da linha de base.
Em resposta à glicoprivação induzida pela ingestão de alimentos de tratamento com 5-Ten-D-glicose ou insulina, hiperglicemia contundente e glucagon circulante reduzido e ácidos graxos livres sem afetar a corticosterona.
A expressão de dbi-mRNA no complexo vagal dorsal foi repetida através de sinais de renascimento, incluindo a agonista do receptor de glp-1 e a agonista da exendina-4, com diferenças regionais observadas sobre os subnúcleos.
O bloqueio de anticorpo de sinalização de ODN ou antagonista do receptor umedeceu parcialmente os efeitos anoréticos dos agonistas do receptor GLP-1 em ratos de comida e gordura. Essas intervenções não alteraram a ingestão de caulina induzida por GLP-1RA ou EMEs, o que indica que o ODN contribui para a supressão do apetite, mas não o mal-estar.
O TDN melhorou a distância da glicose e suprimiu a ingestão de alimentos quando administrada centralmente. Em camundongos com sobrepeso, induziu injeções periféricas diárias de TDN, hipófise de longo prazo e 4,7% de perda de peso corporal por nove dias.
Os estudos hiperinsulinêmicos-euglicêmicos confirmaram o aumento da taxa de infusão de glicose e suprimiu a produção hepática de fígado em camundongos tratados com TDN.
O autor conclui que o ODN produzido no complexo vagal dorsal atua como um sinal derivado da disponibilidade de nutrientes que regula o apetite, o desperdício de glicose e a liberação de glucagon.
A ingestão de alimentos suprimida de ODN central e o controle glicêmico aprimorado sem desencadear náusea ou efeitos colaterais cardiovasculares. A expressão de ODN aumentou em resposta aos agonistas da glicose e receptor de GLP-1 e antagonizou sua sensibilidade ao receptor prejudicada por insulina e anorexia induzida por GLP-1Ra.
A administração sistêmica de uma derivada ímpar sintética, TDN, imitou esses efeitos em roedores de gordura, reduziu a ingestão de alimentos e o metabolismo melhorado da glicose. É importante que nem o ODN central nem o TDN tenha alterado a temperatura corporal nuclear, a atividade física ou a freqüência cardíaca, o que sublinha seu perfil de segurança favorável.
Os pesquisadores sugerem que o caminho do receptor da ODN pode ser direcionado para alcançar a perda de peso e as melhorias metabólicas sem intolerância gastrointestinal que é frequentemente associada a tratamentos atuais para a obesidade e diabetes tipo 2.
Escrito para você por nosso escritor Justin Jackson, editado por Sadie Harley, e controlado por fatos e revisado por Andrew Zinin-este artigo é o resultado de um trabalho humano cuidadoso. Confiamos que os leitores gostam de você manter vivos o jornalismo científico independente. Se este relatório for importante para você, considere uma doação (especialmente todos os meses). Você recebe uma conta livre como um agradecimento.
Mais informações:
Caroline E. Geisler et al., Gliotransmissão do europeptídeo octo do cérebro posterior como alvo terapêutico para balanço energético sem náusea ou EMEs, Medicina Translacional da Ciência (2025). Doi: 10.1126/scitranslmed.adu6764
© 2025 Science X Network
Citar: O ODN do pepptide cerebral reduz a fome e aumenta a regulamentação da glicose em estudos de ratos (2025, 26 de julho) recuperados em 26 de julho de 2025 de https://medicalxpress.com/news/2025-07-brain-teptide-dhunger-boosts.html
Este documento está sujeito a direitos autorais. Além de qualquer comércio justo com o objetivo de estudos ou pesquisas particulares, nenhuma parte pode ser reproduzida sem uma permissão por escrito. O conteúdo é fornecido apenas para fins de informação.